Alkohol, ethanol, ethanol, etylalkohol, líh - vlastnosti, výroba, použití, účinky |
 |
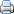 |
 |
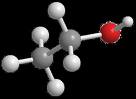 Vzorec alkoholu (ethanolu) jeje C2H5OH. Je to velmi jednoduchá chemikálie. Schematicky je vyjádřen na obrázku níže. Jeho synonymní názvy jsou ethanol, etanol, etylalkohol, líh. Je vyráběn mikroby, které jsou v nádobách s rostlinnou drtí. Mikroby se živí cukrem z této drti a jejich výměškem je právě alkohol. V určité chvíli, když je koncentrace alkoholu již příliš vysoká mikrobi zmírají. Dá se ale vyrobit i uměle. Vzorec alkoholu (ethanolu) jeje C2H5OH. Je to velmi jednoduchá chemikálie. Schematicky je vyjádřen na obrázku níže. Jeho synonymní názvy jsou ethanol, etanol, etylalkohol, líh. Je vyráběn mikroby, které jsou v nádobách s rostlinnou drtí. Mikroby se živí cukrem z této drti a jejich výměškem je právě alkohol. V určité chvíli, když je koncentrace alkoholu již příliš vysoká mikrobi zmírají. Dá se ale vyrobit i uměle.Vlastnosti ethanolu v kostce:
Výroba alkoholu:
Největší část produkce ethanolu se připravuje z jednoduchých sacharidů (cukrů) alkoholovým kvašením působením různých druhů kvasinek, především různých šlechtěných kmenů druhu Saccharomyces cerevisiae. Používá se k tomu jak cukerného roztoku (o maximální koncentraci 20 %), tak přímo přírodních surovin sacharidy obsahující, jako jsou např. brambory nebo cukrová třtina. Kvasný proces probíhá dle sumární rovnice C6H12O6 → 2 C2H5OH + 2 CO2. Kvalita takto získaného ethanolu je velmi závislá na výchozí surovině. Kvašením vzniká zápara, tj. velmi zředěný vodný roztok ethanolu (maximálně 15 %), který vždy obsahuje nežádoucí příměsi, tzv. přiboudliny, zejména vyšší alkoholy (propanol a isopropanol), vícesytné alkoholy (glycerol), ketony (aceton) aj. Čištění se provádí na výkonných destilačních kolonách, přičemž lze získat tzv. absolutní alkohol, obsahující 95,57 % ethanolu a 4,43 % vody. Zbytek vody lze odstranit destilací s bezvodým síranem vápenatým nebo oxidem vápenatým, které vodu vážou nebo dlouhodobým působením hygroskopických látek jako např. bezvodého uhličitanu draselného (potaše) nebo bezvodého síranu měďnatého (modré skalice). Těmito postupy lze získat ethanol o čistotě až 99,9 %. Jinou metodou získávání co nejčistšího ethanolu je tzv. azeotropická metoda, spočívající v destilaci s přídavkem benzínu nebo benzenu, kterou lze získat produkt o čistotě až 99,7 %. Synteticky se ethanol připravuje katalytickou hydratací ethenu (etylenu). Další způsob syntetické přípravy spočívá v katalytické hydrogenaci acetaldehydu, který může být průmyslově vyráběn hydratací acetylenu. Prostorovou geometrii molekuly ethanolu znázorňuje obrázek vlevo. I když je v molekule zachována volná otáčivost podle σ-vazeb mezi uhlíkovými atomy i mezi uhlíkem a kyslíkem, zaujímá konformaci, při které nejsou atomy vodíku na sousedních atomech uhlíku resp. kyslíku navzájem v zákrytu. Vzhledem k přítomnosti hydroxylové skupiny OH v molekule, jejíž vodíkový atom může vytvářet vodíkovou vazbu s kyslíkovým atomem jiné molekuly ethanolu, je bod varu této látky vyšší, než by se dalo očekávat vzhledem k jeho molekulové hmotnosti (78,3 °C místo předpokládaných −42 °C u nepolárních látek jako je stejně hmotný propan, nebo −24 °C u polárních látek bez vodíkových můstků jako je dimethylether). Protože vazby C–O i O–H jsou polární, je proto molekula ethanolu polární. Rozpouští se proto je velice špatně v nepolárních rozpouštědlech, s polárními rozpouštědly (např. s vodou) se většinou mísí neomezeně. S vodou vytváří tzv. azeotropickou směs, která obsahuje 95,57 hmotnostních procent ethanolu a která za normálního tlaku (1013 hPa) vře při 78,1 °C, přičemž složení plynné a kapalné fáze je stejné. Proto se směs tohoto složení již nedá další destilací rozdělit. Použití: Nejznámějším použitím ethanolu je výroba alkoholických nápojů. Také se používá pro zlepšení výkonu spalovacích motorů jako přídavek do pohonných hmot. V lékařství se používá jako rozpouštědlo (např. jódu, tím vzniká tzv. jodová tinktura), při přípravě některých kapalných přípravků pro vnitřní i vnější použití (Při požití je třeba dát pozor a bezprostředně poté neřídit motorová vozidla) a k dezinfekci neporaněné kůže. V oblasti kosmetiky se uplatňuje při výrobě voňavek. Tento alkohol má své místo i při výrobě čisticích prostředků, např. Okeny. Působení na organismus: Působení ethanolu závisí na tom, jak je organizmus zvyklý ho přijímat a jaká je celková tělesná váha. Proto je jeho dávkování velice relativní. V malých dávkách ethanol krátkodobě způsobuje euforii a pocit uvolnění, ve větších pak deprese, ztrátu koordinace pohybů těla (působením na mozeček), sníženou vnímavost, prodloužení reakce a útlum rozumových schopností, případně i agresivitu. Mnohem významnější vliv na lidské tělo a psychiku má jeho metabolit, acetaldehyd, který v těle vzniká působením enzymu alkoholdehydrogenázy a který atakuje zejména proteiny obsahující thiolové skupiny (–SH). Teprve působením acetaldehyddehydrogenázy se acetaldehyd pomalu v těle odbourává až na neškodnou kyselinu octovou. Dlouhodobé a opakované působení ethanolu prostřednictvím acetaldehydu vede k závislosti na něm (k alkoholismu) a způsobuje cirhózu jater. Byl prokázán i karcinogenní účinek acetaldehydu u laboratorních zvířat, u člověka zatím definitivně stanoven nebyl. V poslední době (2005) bylo zjištěno, že zvýšená hladina ethanolu může stimulovat bujení mikroorganismu Acinetobacter baumannii, který je odpovědný za pneumonii (zánět plic), meningitidu a infekční záněty močových cest. Proto užívání alkoholických nápojů jako „vnitřní dezinfekce“ je značně dvousečným prostředkem. Vzhledem k tomu, že biochemická podstata jeho působení na lidský organismus je obdobná jako u methanolu, ale je méně riziková, používá se jako protijed (antidotum) při otravách methanolem. Zdroj: wikipedia.org.
|











 Alkohol je dobrý tehdy, když potřebujeme něco zapít - ať už je to něco příjemné nebo zlé. Když to zapíjíme moc dlouho, tak se ale utopíme.
Alkohol je dobrý tehdy, když potřebujeme něco zapít - ať už je to něco příjemné nebo zlé. Když to zapíjíme moc dlouho, tak se ale utopíme.










